Pour optimiser l’efficacité d’un traitement, le modèle doit aussi considérer d’autres composantes comme la population de cellules cancéreuses, les cellules immunitaires, des protéines ou des cytokines. Si une thérapie combine plusieurs médicaments, le modèle doit inclure un sous-modèle par médicament afin de suivre leur concentration dans le sang. En effet, il est important de modéliser chacun d’entre eux puisque l’effet d’une combinaison de thérapies n’est pas nécessairement additif.
Dans le cas où l’effet de la combinaison est supérieur à la somme des effets individuels, on observe de la synergie. Dans le cas contraire, quand l’effet combiné est inférieur à la somme des effets individuels, on observe de l’antagonisme.
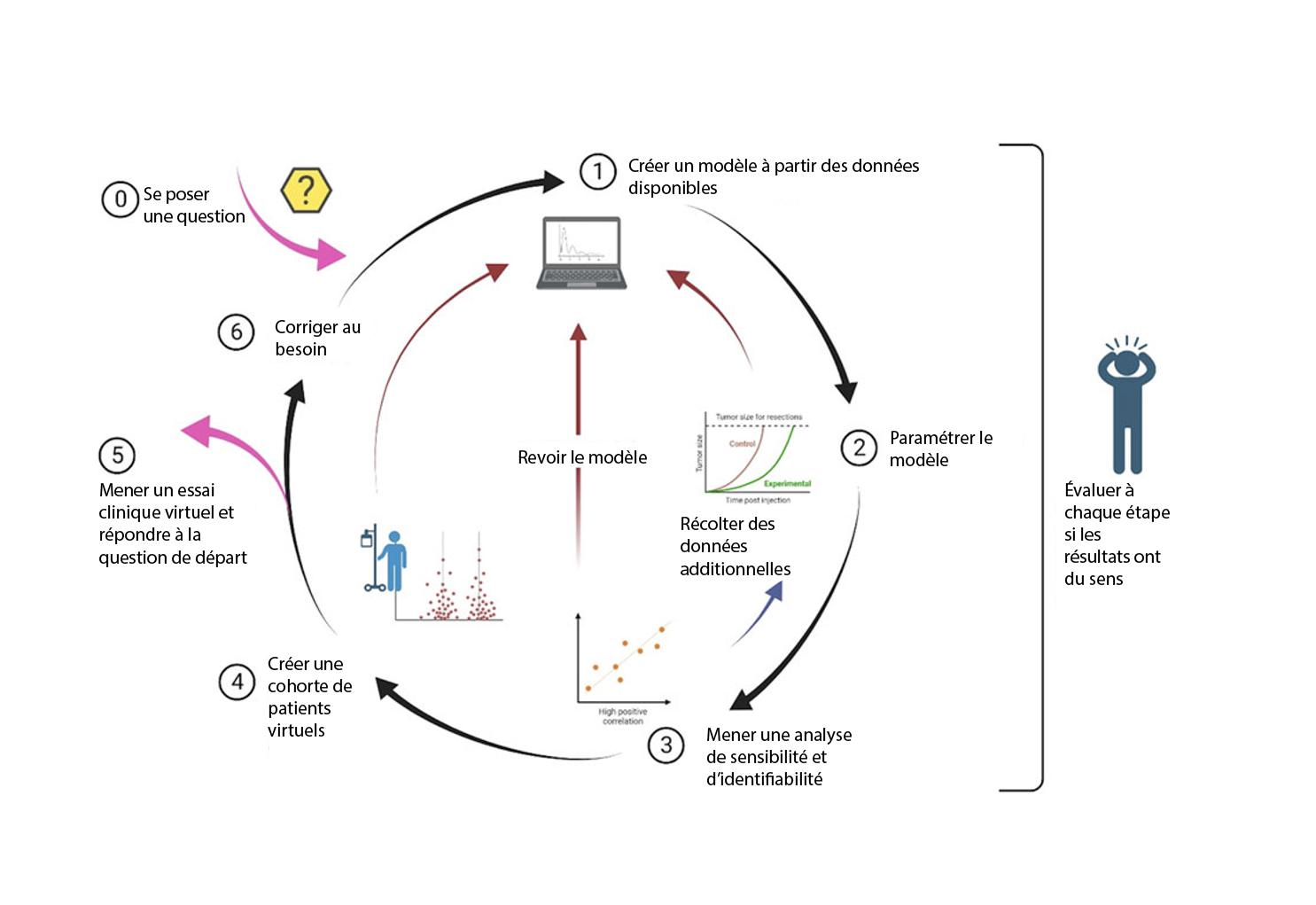
Une fois tous ces éléments implémentés et paramétrés, il est possible ensuite d’investiguer comment des modifications, telles que la taille et la fréquence de la dose, affectent les résultats prédits. C’est ce qu’on appelle « l’optimisation (ou la rationalisation) du traitement ». Cela permet de tester des milliers de scénarios sans avoir besoin d’essais cliniques.
Il est aussi possible d’investiguer la variabilité interindividus en créant des ensembles de paramètres, puis de faire une simulation pour chaque ensemble. Différents algorithmes peuvent aider à générer des profils de patients en créant des ensembles de valeurs réalistes qui ont des résultats réalistes.